Оставьте сообщение
Мы скоро тебе перезвоним!
 Ваше сообщение должно содержать от 20 до 3000 символов!
Ваше сообщение должно содержать от 20 до 3000 символов!
 Пожалуйста, проверьте свою электронную почту!
Пожалуйста, проверьте свою электронную почту!
Отправить
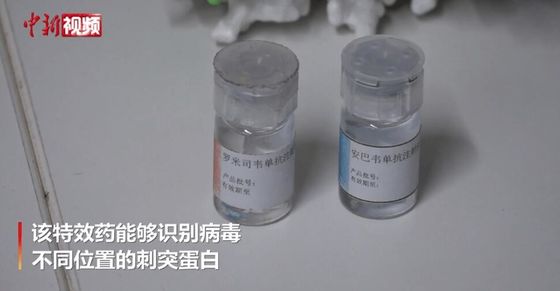
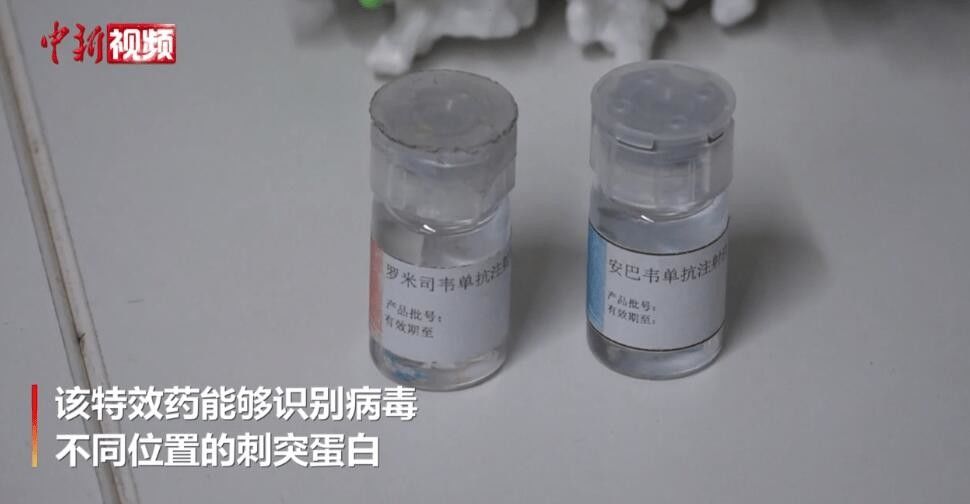
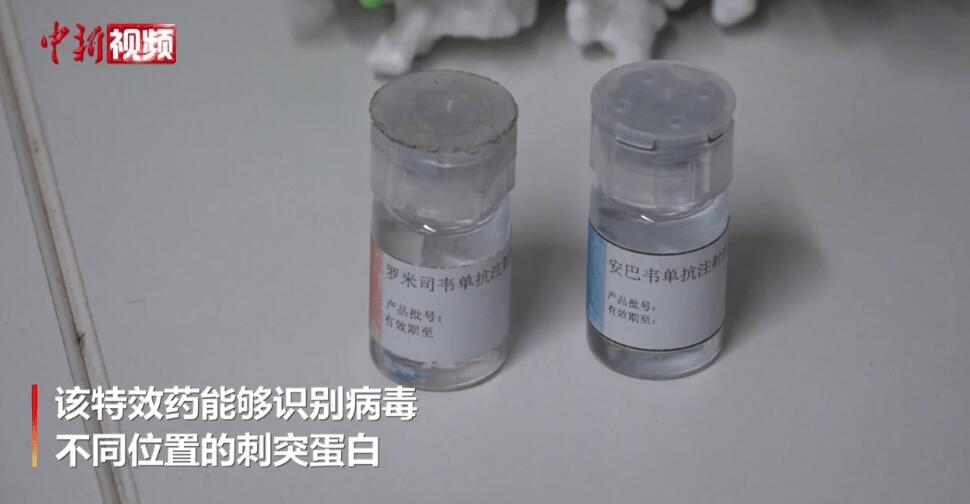
Больше информации способствует лучшему общению.
Господин
- Господин
- Миссис
Хорошо
Отправлено успешно!
Мы скоро тебе перезвоним!
Хорошо
Оставьте сообщение
Мы скоро тебе перезвоним!
 Ваше сообщение должно содержать от 20 до 3000 символов!
Ваше сообщение должно содержать от 20 до 3000 символов!
 Пожалуйста, проверьте свою электронную почту!
Пожалуйста, проверьте свою электронную почту!
Отправить